در روش کاری PR در سروو موتور دلتا، پیشروندی هست برای تندی ایستا (سرعت ثابت) یا speed control ، در این نوشته هم این پیشروند رو یادمیگیرید و هم روش های گوناگون فراخوانی یک پیشروند تا از اجرای پیشروند دیگری بازداری کند.

پدید آمدن الکتریسیته ساکن (الکتریسیته ایستا) و کشش و رانش
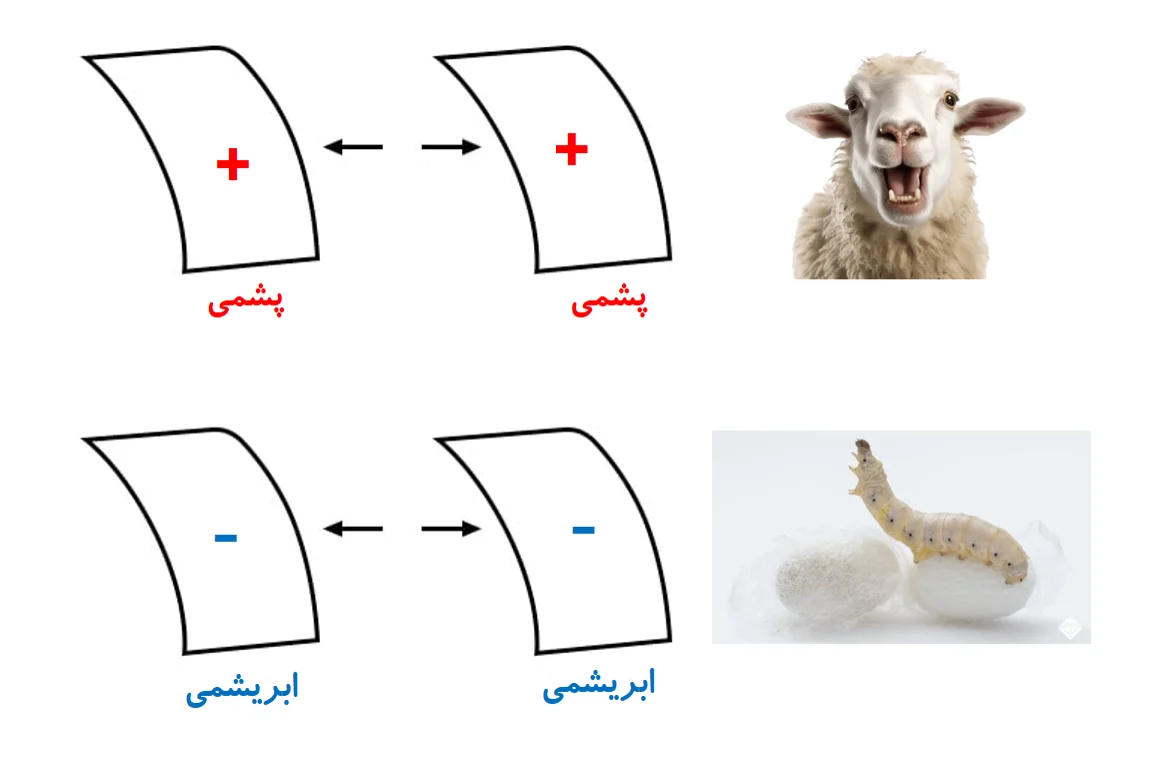
سده ها پیش دریافتند که پس از مالش برخی چیزها به هم، آنها به هم کشش پیدا میکنند. برای نمونه پس از مالش پارچه ابریشمی به شیشه، این دو میخواهند به هم بچسبند. اگر هم بخواهیم آنها را از هم جدا کنیم، نیروی کشش بین این دو نمایان میشود.
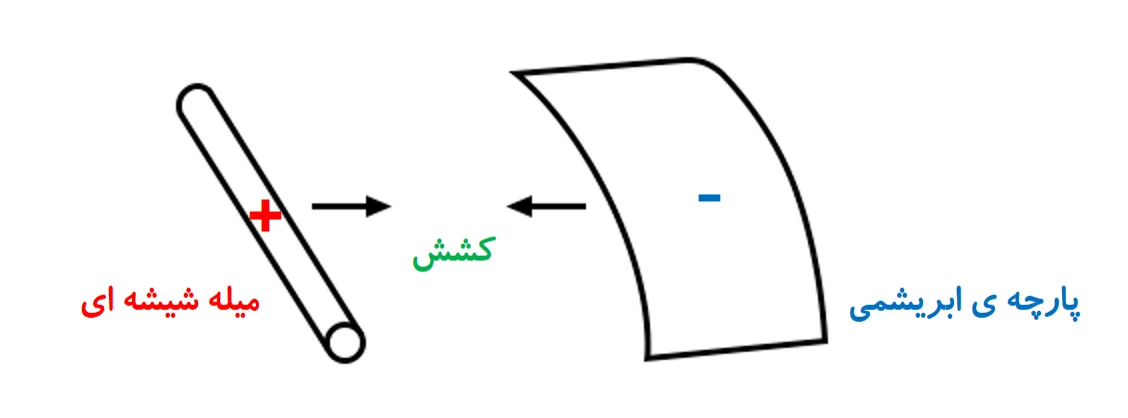
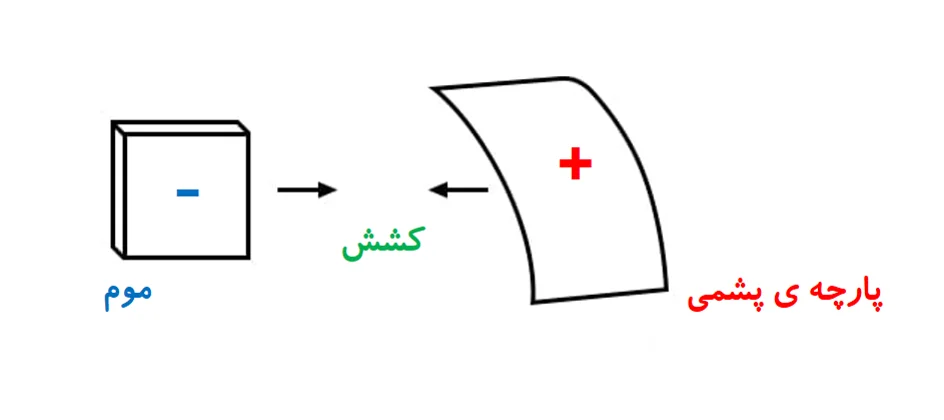
ابریشم و شیشه تنها ماده های شناخته شده ای نیستند که اینگونه رفتار میکنند. موم و پارچه ی پشمی هم جفت دیگری هستند که پس از مالش به یکدیگر، به هم کشش دارند.
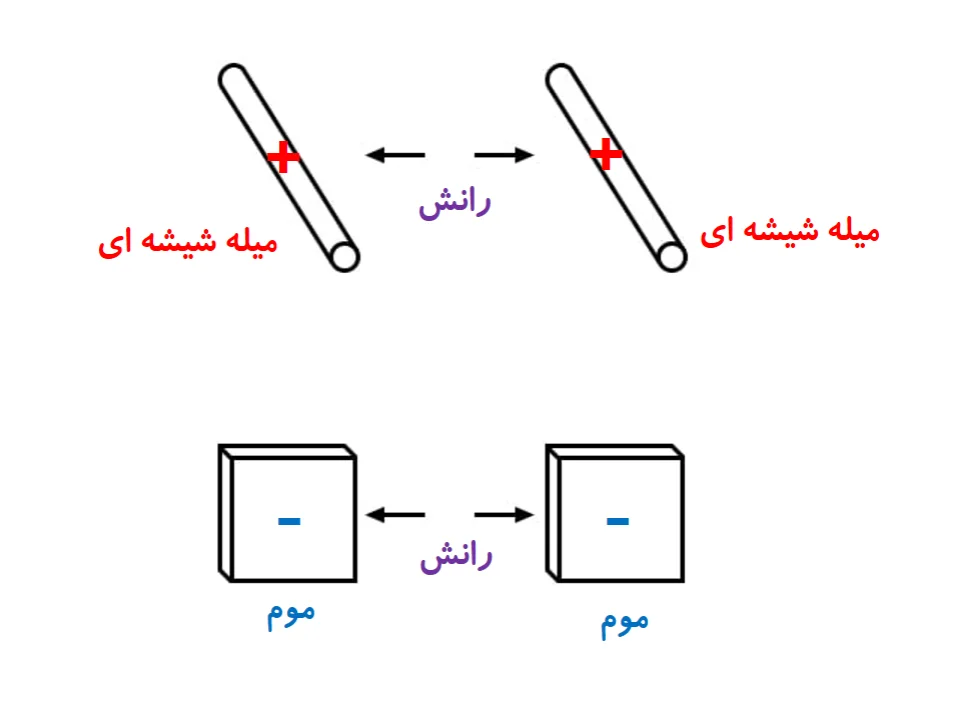
همچنین ماده های یکسان، هنگامی که به جفت وابسته شان مالیده شوند، همدیگر را پس میزنند.
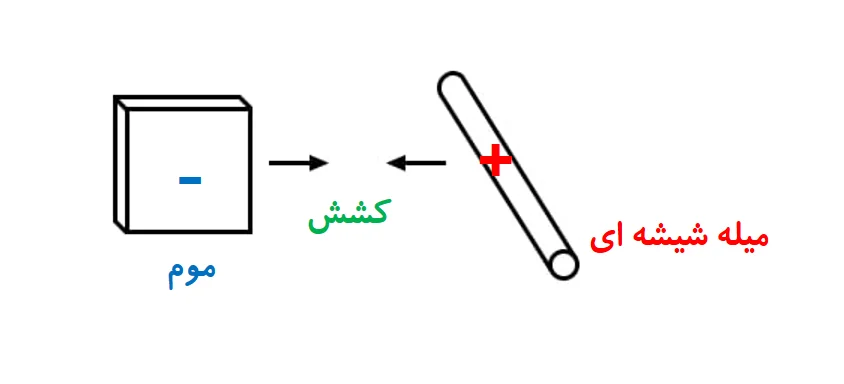
همچنین شیشه ای که به ابریشم مالیده شده، به مومی که به پشم مالیده شده، کشش دارد.
دریافته شده که همه ی چیزهایی که پس از مالش، رفتار کشش یا رانش به ماده های دیگر نشان میدهد در دو گروه دسته بندی میگردند.
- کشش به شیشه و رانش با موم
- کشش به موم و رانش با شیشه
هیچ چیزی نیست، که هم به موم و هم به شیشه کشش داشته باشد، یا اینکه تنها به یکی از آنها کشش داشته باشد.
همچنین در مورد پارچه هایی که به آنها مالیدیم، دریافته شده که اگر پس از مالش دو پارچه ی ابریشمی به دو تکه شیشه، نه تنها شیشه ها هم را میرانند، بلکه پارچه های ابریشمی هم یکدیگر را میرانند. همین پدیده برای پارچه های پشمی مالیده شده به موم هم رخ میدهد.
دیدن این رخداد بس شگفت بود. هیچیک از این چیزها با مالیدن، آشکارا دگرگون نشده بودند، ولی بیگمان رفتارشان دگرگون گشته. هر چه بود که این مادهها را وامیداشت یکدیگر را بکشند یا برانند، ناپیدا بود.
واژه شناسی:
آبگون= مایع ، سنگون=جامد ، هواگون =گاز.
برخی آزمایشگران گمان بردند که آبگون های (مایع) نادیدنی هنگام مالیدن از چیزی به چیز دیگر جابهجا میشود و این آبگون ها (مایعها) نیرویی را از دور پدید میآورند. شارل دوفه از نخستین کسانی بود که نشان داد مالش برخی جفت چیزها دو دگرگونی گوناگون پدید میآورد: کشش و رانش. این جابهجایی آبگون (مایع) انگاشته، بار (charge) نام گرفت.
بنجامین فرانکلین، پژوهنده پیشگام، به این دریافت رسید که تنها یک آبگون (مایع) میان چیزهای مالیده شده جابجا میشود و دو گونه بار چیزی جز فراوانی یا کمی همان آبگون (مایع) نیست. او پس از آزمایش با موم و پشم، گفت پشم بخشی از این آبگون نادیدنی را از موم میگیرد؛ پس پشم پرآبگون و موم کمآبگون میشود و این نابرابری، نیروی کشش میان آن دو را پدید میآورد. بدینسان، او بار موم را پسا (منفی) و بار پشم را پیشا (مثبت) نامید.
اندازهگیریهای درست بار الکتریکی را شارل کولن در دهه ۱۷۸۰ انجام داد. او توانست نیروی میان دو چیز بارگرفته را بسنجد. یکای بار الکتریکی کولن است که به نام او گذارده شد. اگر دو چیز نقطهای (چیز پنداره ای که رویه = سطح ندارد) هر یک، یک کولن بار میداشتند و یک متر از هم دور بودند، نیرویی نزدیک به ۹ میلیارد نیوتن (دو میلیارد پوند) پدید میآوردند، چه کشش چه رانش. پژوهشها نشان داد که یک کولن برابر است با کمی یا فزونی نزدیک به ۶۲۵۰ کوادریلیون (=۱۰^۱۸) الکترون. پس بار یک الکترون چیزی نزدیک به ۰٫۰۰۰۰۰۰۰۰۰۰۰۰۰۰۰۰۰۱۶ کولن است و آن را بار پایه مینامند.
سالها پس از آن آشکار شد که این آبگون براستی ریزه(ذره) های کوچکی است که الکترون نام گرفت؛ برگرفته از واژه یونانی amber =کهربا (که خود با مالش باردار میشد).
ساختار اتم
آزمایشها نمایاندند که همه چیز از ریزه هایی(ذره) به نام اتم ساخته شده و اتم نیز از ریزه های بنیادین کوچکتری به نام های پروتون، نوترون و الکترون. برای نمونه، هیدروژن سبک (پروتیوم) تنها یک پروتون و یک الکترون دارد و بی نوترون است.
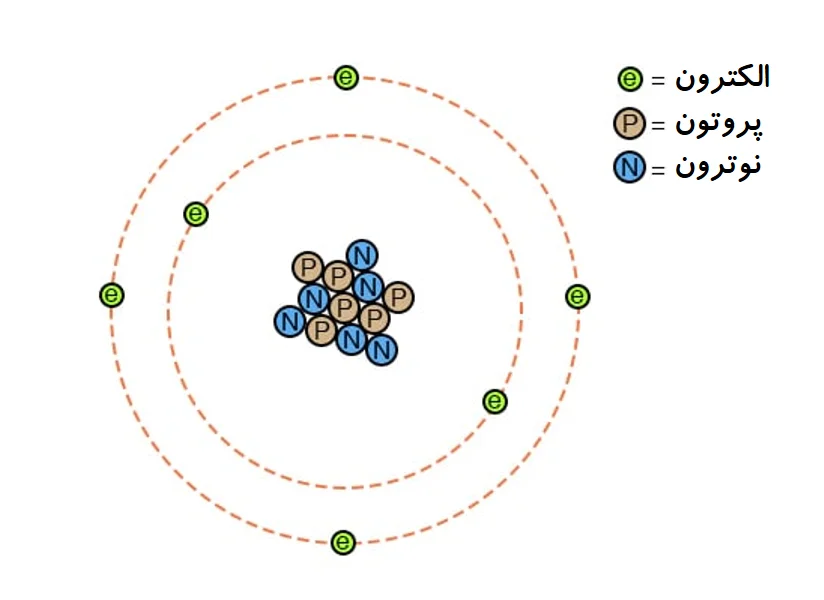
این نمونه ساده از اتم کربن است: شش پروتون، شش نوترون و شش الکترون. گروه پروتون ها و نوترون ها در کانون(مرکز) اتم ، هسته نامیده میشود. پروتونها و نوترونها در هسته، سفت به هم چسبیده اند. شمار پروتونها شناسه هر اتم است، اگر شمار پروتون ها در یک اتم دگرش یابد(تغییر کند)، گونه ی اتم هم دگرگون میشود. برای نمونه اگر سه پروتون از هسته سرب برداریم، زر خواهیم داشت! چسبیدگی سفت پروتونها و نوترون ها به هم در هسته، شناسنامه (در اینجا هویت) شیمیایی را نگاه میدارند و بدینسان کیمیاگران در ساخت زر ناکام ماندند.
نوترونها در سنجش با پروتونها، تأثیر بسیار کمتری بر ویژگی و هویت شیمیایی یک اتم دارند، اگرچه همانند پروتونها، پیوند سفتشان در هسته، افزودن یا کاستن آنها به هسته را دشوارکرده. اگر نوترونها به هسته افزون یا کم شوند، اتم همچنان هویت شیمیایی خود را نگاه میدارد، اما وزن آن کمی دگرش یافته و شاید ویژگی های مانند پرتوزایی پدید آید.
الکترونها که در لایه هایی به گرد هسته میچرخند، بسیار آزادترند. به آسانی جابجا میشوند و در همسنجی (مقایسه) با پروتون و نوترون، با نیروی بسیار کمتری میتوان آنها را از اتم جدا کرد.
اگر الکترون از اتم برود، اتم همچنان هویت شیمیایی خود را نگاه میدارد، ولی یک نابرابری برجسته پدید میآید. چون پروتون ها بار پیشا(مثبت) و الکترون ها بار پسا(منفی) دارند، با رفتن یک الکترون، یک بار پسا از اتم میرود و اکنون اتم با یک پروتون بیشتر، بار پیشا دارد. اتم با بار پیشا، اتم های دیگر با بار پسا را میکشد و اتم های دیگر با بار پیشا را میراند.
الکتریسیته ساکن یا الکتریسته ایستا
نابرابری بار الکتریکی میان چیزها، الکتریسیته ایستا یا الکتریسته ساکن نامیده میشود. آن را «ایستا» مینامند زیرا الکترونهای جابهجا شده پس از رفتن از یک چیز نارسانا به چیز دیگر، گرایش دارند در جای خود بمانند. درباره ی موم و پشم، آزمایشهای بیشتر نشان داد که الکترونها از پشم به اتمهای موم میروند، بار موم پسا (منفی) است چون بیشبود الکترون دارد و بار پشم پیشا (مثبت) است چون کمبود الکترون دارد.
بنابراین، چیزی که اتمهای آن الکترون دریافت کرده باشد و الکترون بیشبود داشته باشد، بار پسا و چیزی که الکترون ها از اتمهایش رفته اند و کمبود الکترون دارد، بار پیشا (مثبت) خواهد داشت.